특징
- Cell proliferation dye는 살아있는 세포내로 확산되며 장기적인 cell labeling에 이용됩니다. 처음에는 형광을 내지 않지만 세포내 esterase에 의해 형광 염료로 전환되고 동시에 세포내 단백질의 아민기와 반응하여 형광 conjugate를 형성합니다.
- 염색 직후에는 유세포 분석에 의해 단일의 bright fluorescent population이 관찰되지만 세포 분열을 하면 FACS 히스토그램에서 연속적으로 희미한 형광 피크를 보입니다.
- In vivo 및 in vitro 에서 세포 분열을 추적하는데 사용될 수 있습니다.
- 후속 면역 염색을 위한 고정 및 투과 과정에서도 형광이 유지됩니다.
- ViaFluor® 405와 ViaFluor® 488은 CFSE보다 독성이 약합니다.
구성
- Lyophilized dye in single use vials
- Anhydrous DMSO for dissolving dye
종류
| Cell
Division Tracking Dyes |
Cat. No. |
Ex/Em (nm) |
Detection
channel |
Features |
| ViaFluor® 405 SE Cell
Proliferation Kit |
30068 |
408/452 |
Pacific Blue® |
• Track cell division by dye
dilution using flow cytometry |
| ViaFluor® 488 SE Cell
Proliferation Kit |
30086 |
493/532 |
FITC |
•
ViaFluor® 488 is a unique, improved green dye to replace CFSE |
| ViaFluor® CFSE Cell
Proliferation Kit |
30050 |
495/519 |
FITC |
•
ViaFluor® 405 replaces CellTrace™ Violet |
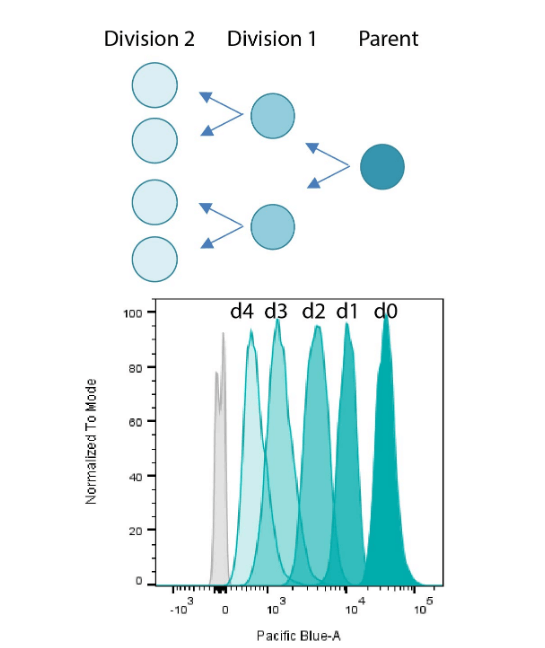
ViaFluor® SE cell proliferation assay의 원리
A. 세포는 ViaFluor® SE dye로 공유적으로 라벨링됩니다. 세포 분열할 때마다 마다 딸세포는 형광 라벨의 절반을 물려받습니다.
B. ViaFluor® 405 SE 로 라벨링된 Jurkat 세포의 유세포 분석 히스토그램
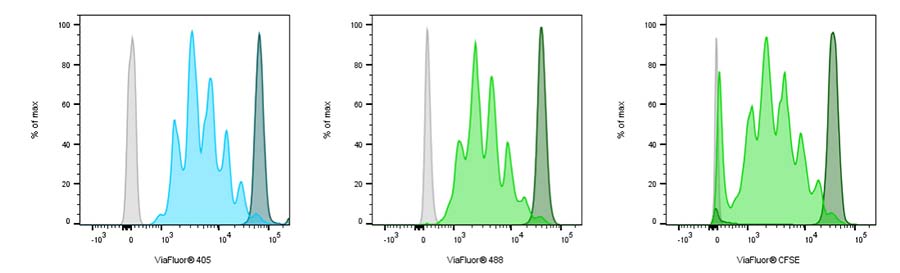
ViaFluor® 405 (left), ViaFluor® 488 (center), ViaFluor® CFSE (right)를 이용한 Human PBMC 염색
세포를 Dynabead Human T-Activator CD3/CD28 bead와 100ng/ml IL-2로 자극하여 4일 후 분석하여 CD3+ T-cell을 염색.
unstimulated cell은 dark peak로, unstained cell은 gray로 표시됨.
실험 방법
- 세포를 해동하고 계수합니다.
- ViaFluor®를 이용하여 세포를 염색합니다.
- 결합되지 않은 염료를 퀜치하고 세포를 씻어냅니다.
- 관심 세포를 분할하도록 유도합니다.
- 원하는 시간 동안 배양합니다.
- Live-or-Dye™ 라는 죽은 세포를 염색하는 염료로 세포를 염색합니다.
- 관심 있는 세포 유형에 대한 표면 마커를 식별하기 위해 항체로 염색합니다.
- (선택 사항) 세포를 고정하고 투과화합니다.
- (선택 사항) 관심있는 세포 내 마커를 염색합니다.
- 유세포 분석을 진행합니다.
데이터
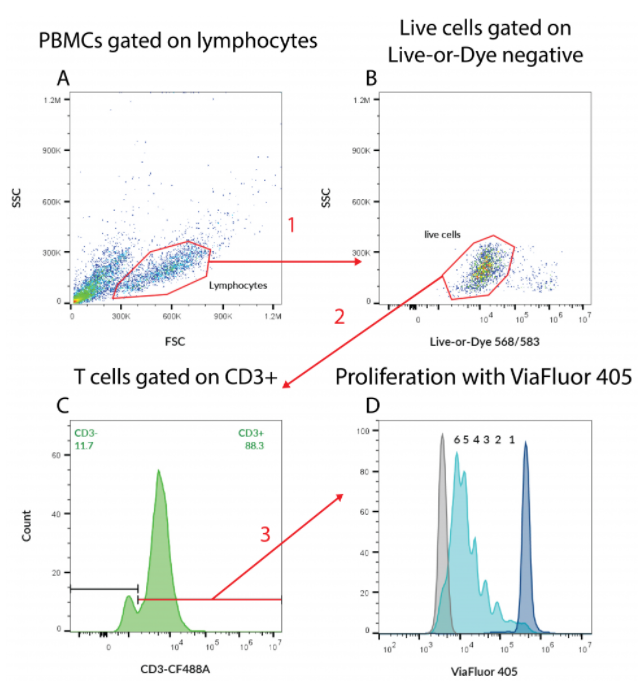
PMBC에서 T cell 증식 관찰
(이 경우, 농도 경사에 의해 과립구가 고갈된) PBMC를 ViaFluor®405로 표지하고 5일 동안 배양한 다음 Live-or-DyeTM 568/573 dead cell stain과 CD3 (RIV9)-CF®488A로 염색함.
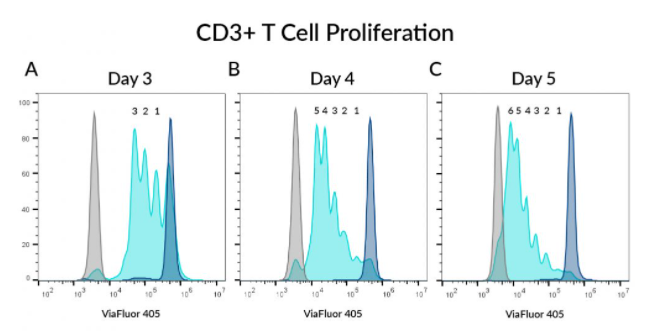
CD3+ T세포 증식 관찰
PBMC를 1uM ViaFluor®405SE로 라벨링된 후, IL-2와 CD3/CD28 beads로 배양하여 T cell을 활성화한 후 살아있는 CD3+ T 세포를 지정된 시간 후에 분석합니다. ViaFluor®405 피크 패턴을 보면, T 세포가 몇 번의 세포 분열을 했는지 알 수 있습니다. A) 3일차에는 3번의 뚜렷한 세포 분열 피크가 시안(cyan) 색상으로 확인되었고, B) 4일차에는 5번의 뚜렷한 세포 분열 피크가 보였고, C) 5일차에는 6번의 뚜렷한 세포 분열 피크가 보였습니다. (짙은 파란색 피크로 표시된) 자극되지 않은 T 세포는 세포 분열이 일어나지 않은 것으로 보였습니다. ViaFlour®405로 염색되지 않은 T 세포는 회색으로 표시했습니다.
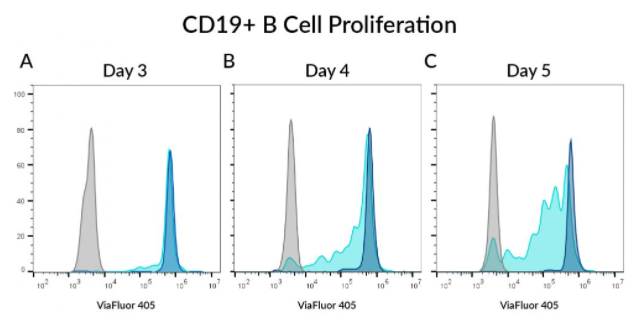
CD19+ B 세포 증식 관찰
PBMC는 1uM ViaFluor®405 SE로 라벨링하여 IL-2와 CD3/CD28 구슬과 함께 배양한 후, 지정된 시간 후에 살아있는 CD19+ B 세포를 분석하였습니다. IL-2 처리는 일부 B 세포의 증식을 유도했지만, T 세포에 비해 덜 했고 시간도 오래 걸렸습니다. (그림3 참고) A) 3일차에는 세포 분열 피크(cyan)가 보여지지 않았고, B&C) 4일차와 5일차에는 일부 세포 분열이 나타나기 시작했습니다. (짙은 파란색 피크로 표시한) 자극되지 않은 B 세포는 세포 분열을 거치지 않았습니다. ViaFluor®405 로 라벨링하지 않은 B세포는 회색으로 표시했습니다.
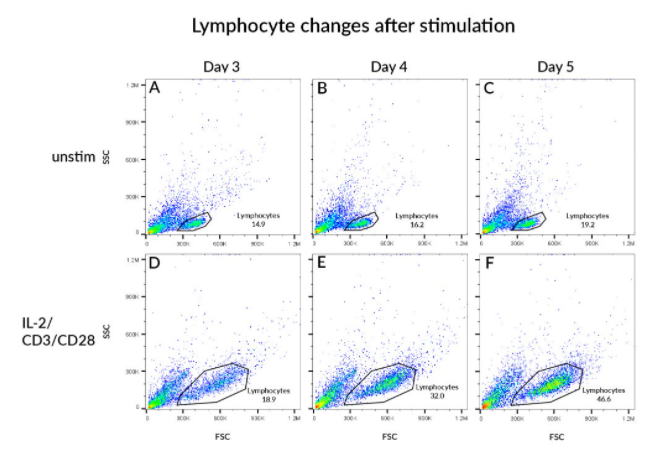
자극 후 림프구 변화 관찰
PBMC는 IL-2와 CD3/CD28 구슬과 함께 배양하여 T 세포 활성을 하고 지정된 시간이 지난 후 FSC/SSC를 분석하였습니다. A-C에서는 자극되지 않은 PBMC를 볼 수 있고, A) 3일차, B) 4일차, C) 5일차일 때 림프구 집단의 세포는 동일하게 유지되고 cell culture에서 대략적으로 비슷한 집단 내 빈도로 존재합니다. D-F에서 IL-2와 CD3/CD28 구슬로 자극한 후, 림프구 집단 내의 세포는 커지고, 크기 변화는 확장된 FSC/SSC 프로필에 반영되는데, (D) 3일차에 드러나고, (F) 5일차에는 더욱 분명해집니다. 또, 림프구 게이트의 세포 빈도는 3일차에서 5일차 사이에 ~19% 증가에서 ~47% 증가하며, T세포가 활발하게 분열하는 것을 반영합니다.
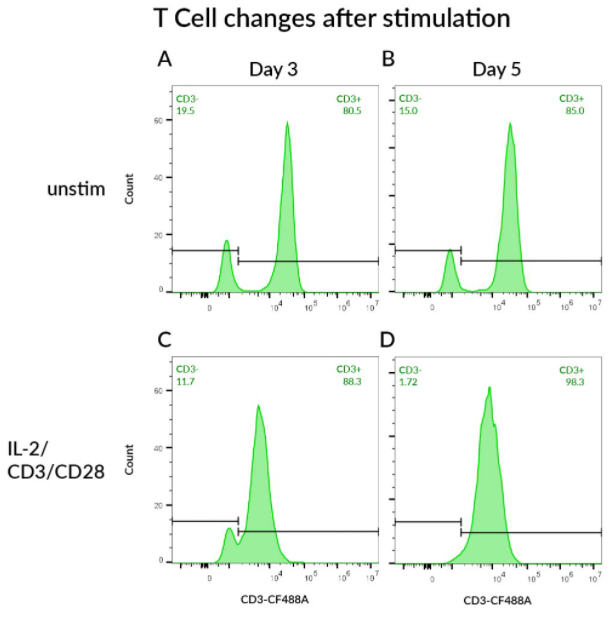
자극 후 T 세포 변화 관찰
PBMC는 IL-2와 CD3/CD28 배양되어 T세포 활성을 유도하고, 정해진 시간 후에 CD3-CF®488A로 T 세포를 라벨링합니다. 세포는 살아있는 림프구에서 게이팅되고 CD3 발현은 FITC 채널에서 분석합니다. A-B에서 자극되지 않은 PBMC를 볼 수 있으며, CD3 신호는 상대적으로 높게 보여지며, CD3+림프구와 CD3-림프구 사이에 간격을 보입니다. 또한, CD3+ 세포의 빈도는 A) 3일차와 B) 5일차에 상대적으로 일정하게 유지됩니다. C-D) IL-2와 CD3/CD28 구슬로 자극된 후, 활성화 후 수용체가 내제화됨에 따라 CD3 신호는 감소합니다. 또한, CD3+ 세포의 빈도는 88%에서 98%로 증가하여 T 세포가 활발히 분열함을 보여줍니다.
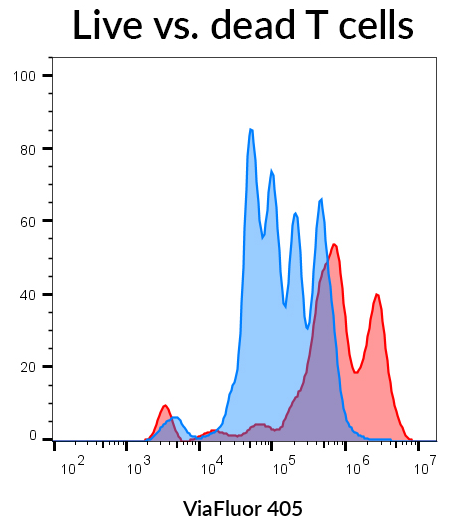
살아있는 T 세포와 죽은 T세포에서의 ViaFluor® 405 신호 관찰
PBMC는 T 세포 활성화를 위해 3일동안 IL-2와 CD3/CD28 구슬과 배양된 후, CD3+ T 세포에 게이팅합니다. 세포는 죽은 세포를 염색하는 Live-or-Dye™ 568/583를 이용하여 세포를 살아있는 세포와 죽은 세포에 게이팅하고, ViaFluor®405를 이용하여 세포 증식을 관찰하기 위해 Pacific Blue channel을 이용하여 확인합니다. (파란색으로 나타낸) 살아있는 T 세포는 4번의 분명한 세포 분열 피크를 보여주는 데 반해, 죽은 세포는 세포는 세포벽에 구멍이 많아 많은 염료를 흡수할 수 있기 때문에, (빨간 색으로 나타낸) 죽은 T 세포는 두개의 밝은 피크를 보여줍니다. 이러한 원리를 이용하여 세포 증식 분석시, 죽은 세포를 제외할 수 있습니다.