특징
- 기존 HepaRG™ 세포의 낮은 CYP2D6의 발현을 보완하기 위해, CYP2D6가 높은 수준으로 발현되도록 엔지니어링 된 HepaRG™ CYP2D6+ cell 입니다.
- CYP2D6에 의해 대사되는 약물에 대한 반응을 연구하는데 유용합니다.
- 물질대사와 독성 연구 및 Induction 연구에 이용됩니다.
| 제품 |
Differentiated
HepaRG CYP2D6+ cells |
| Cat. No. |
HPR6LV01 |
| Size |
1 ml (8M) |
| 사용방법 |
1. Thawing/Plating/General Purpose : MIL600C+ADD670C, 2-3일 마다 관찰 후 media 교체
2. Maintenance/Metabolism : MIL600C+ADD620C, 2-3일 마다 관찰 후 media 교체
3. Induction : MIL600C+ADD640C
4. Serum-free Induction : MIL600C+ADD650C |
| 전용 Media |
Basal Media
• MIL600C - Basal hepatic cell medium
Medium Supplement
• ADD670C - Thawing/Plating/General Purpose
Medium Supplement with antibiotics
• ADD620C - Maintenance/Metabolism Medium Supplement with antibiotics
• ADD640C - Induction Medium Supplement with antibiotics
• ADD650C - Serum-free Induction Medium Supplement with antibiotics
• ADD1001 - Differentiated HepaRG® Mitogenic medium supplement |
실험 데이터
- Wild-type HepaRG™ 세포와 HepaRG™ CYP2D6+ 세포의 유전자 발현 프로파일 비교 분석에서, 두 모델 간의 분화 능력에는 유의미한 차이가 없었으나, 세포 생존율과 미토콘드리아 독성 반응에서 차이가 있음을 발견했습니다.
- Perhexiline 약물에 대한 세포의 생존율과 독성 반응에서 뚜렷한 차이를 보였습니다.
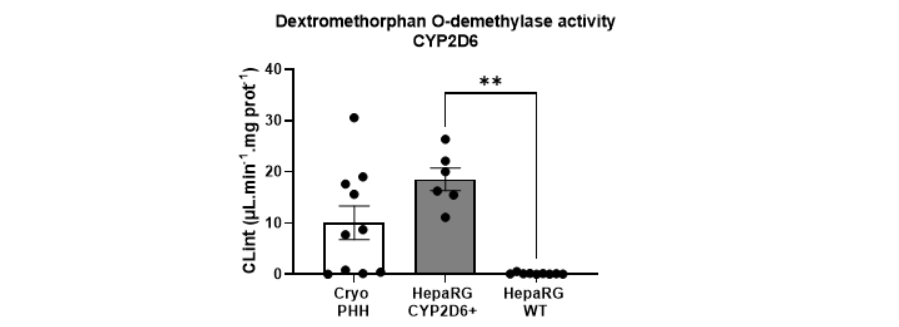
Figure 1. Dextromethorphan O-demethylase activity (CLint values expressed in µL.min-1.mg-1) measured in human hepatocytes (PHH), parental (WT) and CYP2D6+ HepaRG™ cells. Statistics: *p < 0.05 and **p< 0.01 between parental and CYP2D6+ HepaRG™ cells.
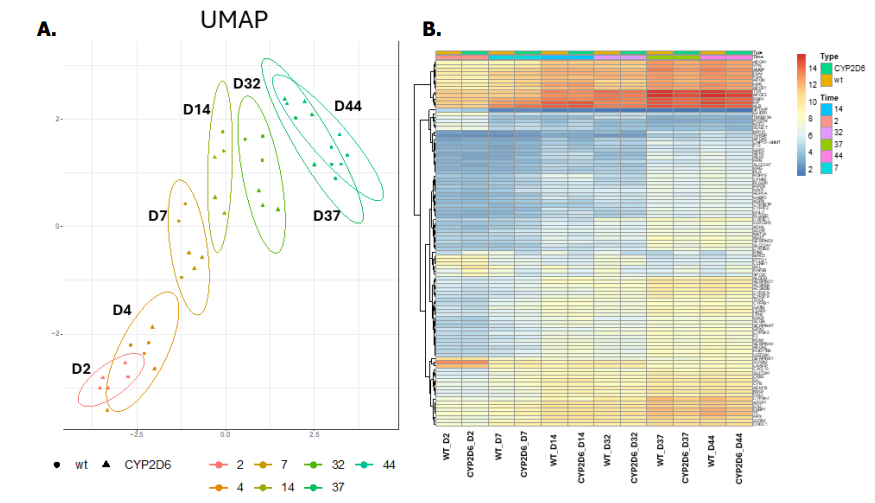
Figure 2. Comparative BRB-seq analysis of parental (wild-type, WT) and CYP2D6+ HepaRG™ cells during proliferation and differentiation. A) UMAP representation of parental (WT) and CYP2D6+ HepaRG™ cells at different time points after plating (2, 4, 7, 14, 32, 37 and 44 days). The first dimension is mainly associated with the time of culture. B) Heatmap of the top 100 most differentially expressed genes during differentiation, with consistent expression patterns observed between parental (WT) and CYP2D6+ HepaRG™ cells.
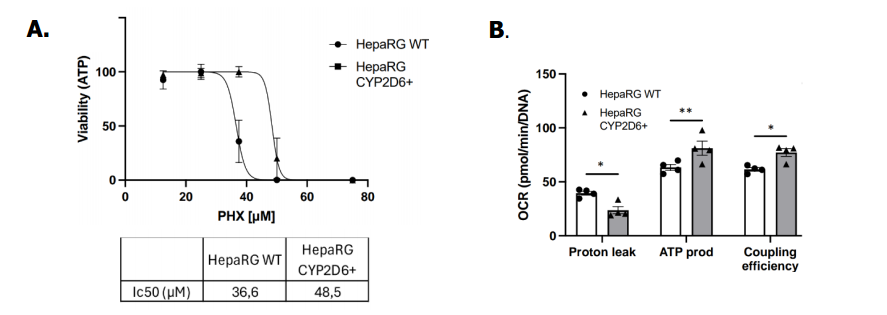
Figure 3. Perhexiline toxicity in parental and CYP2D6+ HepaRG™ cells. A) IC50 in parental (WT) and CYP2D6+ differentiated HepaRG™ cells exposed to various concentrations of perhexiline. B) Oxygen Consumption Rate (OCR) in parental (WT) and CYP2D6+ differentiated HepaRG™ cells exposed to perhexiline at 10mM and quantifications of proton leak, ATP production and coupling efficiency
HepaRG™ CYP2D6+ 사용 방법
- HepaRG™ CYP2D6+ 모델은 Wild Type HepaRG™ 세포와 동일한 방식으로 핸들링 됩니다. 해동, 배양, 유지 관리 방법은 다음의 영상을 참고하세요.
1. Cell Thawing

2. Cell viability measurement and counting
3. Cell seeding
4. Maintenance of the cells
1. THD+1일째 : 위상차 현미경으로 세포 형태를 관찰하고 사진을 촬영합니다. 대사 및 독성 연구를 위해, 동일한 HepaRG™ Thawing/Plating/General Purpose Medium 670을 사용하여 배지를 교체합니다.
2. THD+3일째 : 대사 및 독성 연구를 위해, HepaRG™ Maintenance/Metabolism Medium 620을 사용하여 매 2일마다 배지를 교체합니다. 유도 연구를 위해, HepaRG™ Induction Medium 640/641 또는 HepaRG™ Serum-free Induction Medium 650/651로 배지를 교체하고, 프로토콜에 따라 유도제를 추가합니다. 24시간 후에 유도제를 포함한 배지를 새로 교체합니다.
6-12-24-48-96 well plate의 경우 :
적절한 HepaRG™ media 670/620/640 또는 650을 멸균 용기에 미리 따뜻하게 (12 mL/24 또는 12well plate, 9.6 mL/48 또는 96well plate) 실온에서 준비합니다. 96 well plate의 경우, 미리 따뜻하게 한 적절한 HepaRG™ media 670/620/640 또는 650을 92 x 17 mm petri dish또는 다채널 피펫에 적합한 평평한 바닥 용기에 옮깁니다. 멀티웰 플레이트에서 기존 배지를 제거합니다. 다채널 피펫 또는 적절한 피펫을 사용하여 각 well의 측면에 미리 따뜻하게 한 적절한 HepaRG™ media 670/620/640 또는 650을 부드럽게 추가합니다. 세포 위에 media가 직접 닿지 않도록 주의합니다. well의 배지 수준을 시각적으로 확인합니다. 플레이트를 +37°C 인큐베이터에 다시 넣습니다.
25 cm² 플라스크의 경우 :
적절한 HepaRG™ media 670/620/640 또는 650을 실온에서 미리 따뜻하게 합니다. 미리 따뜻하게 한 적절한 HepaRG™ media 670/620/640 또는 650을 25 cm² 플라스크에 5 mL 옮깁니다. 세포 위에 media가 직접 닿지 않도록 주의합니다. 플라스크의 뚜껑을 닫고, 플라스크를 +37°C 인큐베이터에 다시 넣습니다.
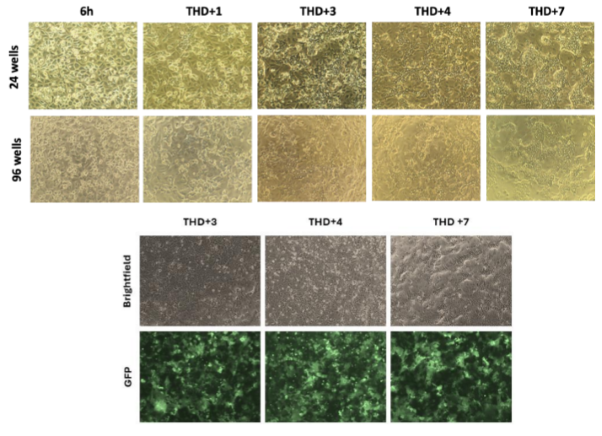
CELL MORPHOLOGY
- 배양 6시간 후에 간세포와 유사한 세포들이 작고 개별화된 분화된 집단으로 나타납니다.
- THD+1에서 THD+4 사이에 세포가 점진적으로 단층 간세포 유사 구조로 재조직됩니다.
- THD+4일째 세포 단층의 재구성이 관찰되며, 간세포 유사 세포가 클러스터 형태로 조직됩니다.
- THD+7일째 간세포 유사 세포가 잘 구분된 섬유 구조로 조직되며, 많은 밝은 담즙관 유사 구조가 형성됩니다.